
Inhoud
- stadia
- Methode 1 Leer de oplosbaarheidsregels
- Methode 2 Gebruik een ezelsbruggetje: NAG SAG
- Methode 3 De basisprincipes van leren
De oplosbaarheid van een verbinding is het vermogen ervan om in water op te lossen. Een onoplosbare verbinding zal een neerslag in oplossing vormen. Van een gedeeltelijk oplosbare verbinding wordt ook gezegd dat deze chemisch onoplosbaar is. Als je je de oplosbaarheidsregels herinnert, zal het je leven gemakkelijker maken als je met chemische vergelijkingen moet werken. Met een beetje tijd, werk en wat mnemonische trucs, zult u alle formules onthouden.
stadia
Methode 1 Leer de oplosbaarheidsregels
-

Groep 1A-zouten zijn oplosbaar. Het periodiek systeem der elementen is georganiseerd in rijen en kolommen die respectievelijk "perioden" en "groepen" worden genoemd. De eerste kolom van de tabel bevat de elementen van groep 1A. Het zijn alkalimetalen. Deze omvatten de elementen Li, Na, K, Cs en Rb.- Voorbeeld: KCl en LiOH zijn oplosbaar in water.
-

De zouten van nitraten, chloraten en acetaten zijn oplosbaar. Wanneer nitraat (met formule NO3), chloraat (ClO-formule3) of lacetaat (met formule CH3COO) vormen zouten, ze worden oplosbaar in water.- Voorbeeld: KNO3NaClO3 en CH3COONa zijn allemaal oplosbaar.
-

Alle ammoniumzouten zijn oplosbaar. Ammoniumleeuw (NH-formule4) vormt zouten die volledig in water dissociëren. Er is geen uitzondering op deze regel.- Voorbeeld: NH4OH is oplosbaar, zelfs als het een hydroxide-ion bevat.
-
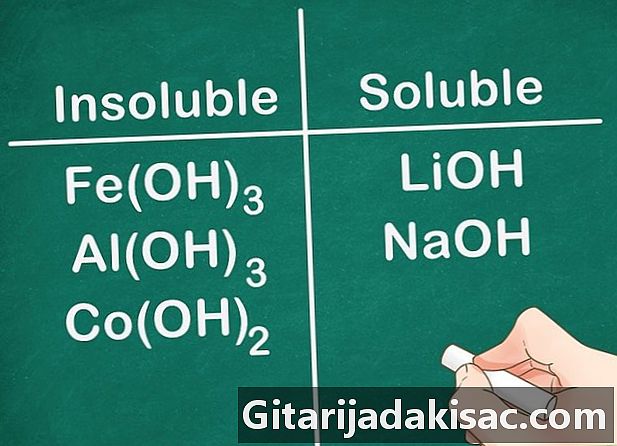
De meeste hydroxylverbindingen zijn onoplosbaar. Sommige hydroxidezouten zijn enigszins oplosbaar. Dit is het geval van hydroxiden gevormd met elementen uit Groep 2 (Ca, Sr en Ba). De hydroxidezouten gevormd met Groep 1-elementen vormen een uitzondering omdat deze elementen nog steeds oplosbaar zijn.- Voorbeeld: Fe (OH)3, Al (OH)3 en Co (OH)2 zijn onoplosbaar, maar LiOH en NaOH zijn oplosbaar.
-
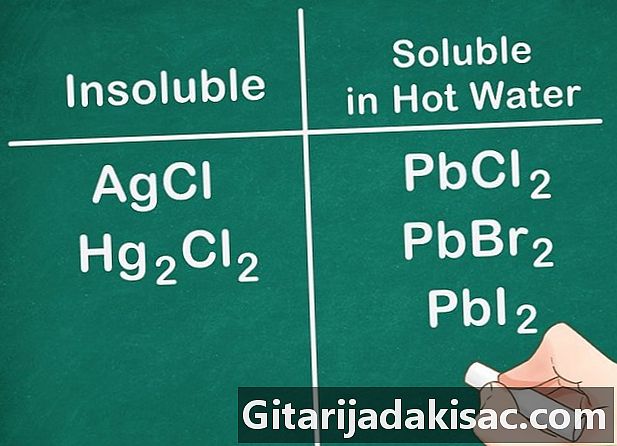
Niet-metaalzouten van groep 17 zijn in het algemeen oplosbaar. Niet-metalen van groep 17 omvatten chloor (Cl), bromide (Br) en liode (I). Geld, lood en kwik zijn uitzonderingen op deze regel. De verbindingen die uit deze niet-metalen en deze ionen bestaan, zijn niet oplosbaar.- Voorbeeld: AgCl en Hg2cl2 zijn beide onoplosbaar.
- PbCl2, PbBr2 en PbI2 zijn oplosbaar in ZEER HEET water.
-
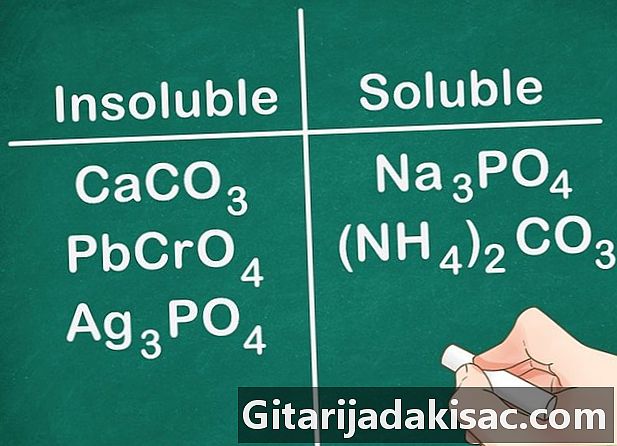
De meeste carbonaten, chromaten en fosfaten zijn onoplosbaar. De chemische formules voor deze elementen zijn: CO3 (carbonaten), CrO4 (chromaten) en PO4 (Fosfaten). Groep 1A metalen en NH-verbindingen4 een uitzondering en zijn oplosbaar.- Voorbeeld: verbindingen zoals CaCO3, PbCrO4 en Ag3PO4 zijn allemaal onoplosbaar terwijl verbindingen zoals Na3PO4 en (NH4)2CO3 zijn oplosbaar.
-
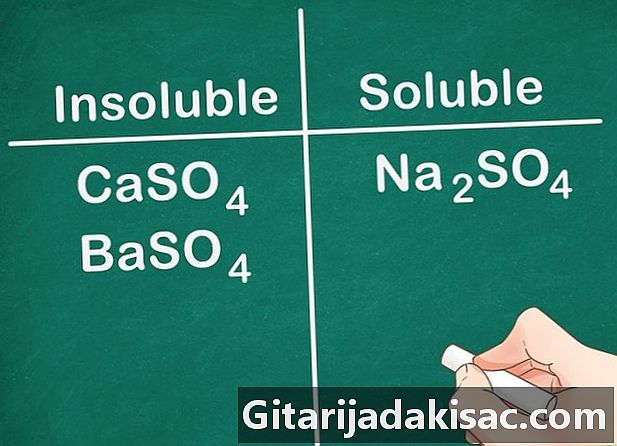
De meeste sulfaatzouten zijn oplosbaar. De meeste zouten, waaronder een SO-ion4 is oplosbaar in water. Ca, Ba, Pb, Ag, Sr en Hg zijn uitzonderingen op deze regel. De sulfaatzouten die deze ionen bevatten, zijn niet oplosbaar.- Voorbeeld: Na2SO4 is volledig oplosbaar terwijl CaSO4 en BaSO4 zijn niet oplosbaar.
-

De meeste zwavelverbindingen zijn onoplosbaar in water. Barium, calcium, magnesium, natrium, kalium en ammonium zijn uitzonderingen op deze regel. Alleen verbindingen gemaakt van deze elementen en sulfide zijn oplosbaar in water.- Voorbeeld: CdS, FeS en ZnS zijn allemaal onoplosbaar.
- Overgangsmetaalsulfiden zijn echter onoplosbaar.
Methode 2 Gebruik een ezelsbruggetje: NAG SAG
-

Gebruik de mnemonic NAG SAG mnemonic. Lacronyme NAG SAG is een gemakkelijke truc om oplosbare verbindingen en uitzonderingen te onthouden. Schrijf de naam NAG SAG en onthoud de betekenis van elke letter. Deze techniek sluit niet alle oplosbaarheidsregels uit, maar bestrijkt een groot deel ervan. Alle letters vertegenwoordigen oplosbare moleculen.- N: Nitraten (NO3)
- A: Acetaten (CH3COO)
- G: Groep 1 alkalimetalen (Li, Na, etc.)
- S: Sulfaten (SO4)
- A: Ammoniumionen (NH4)
- G: niet-metalen van groep 17 (F, Cl, Br, I, enz.)
-

Onthoud de PMA-naam voor de eerste uitzondering. P staat voor Pb (lood). M staat voor de Mercurius (Hg2). A staat voor Silver (Ag). Deze drie ionen zijn nooit oplosbaar met de sulfaatgroep of niet-metalen van groep 17.- Wanneer je de mnemonische truc ziet, teken dan een ster bij het PMA-acroniem en een vergelijkbare ster bij de S en G van SAG om je eraan te herinneren dat dit uitzonderingen zijn.
-

Onthoud de woorden "Castro" en "bar" voor de tweede uitzondering. Het klinkt misschien stom, maar deze woorden helpen je calciumionen (Ca, strontium (Sr) en barium (Ba) te onthouden.) Deze drie ionen zijn nooit oplosbaar in sulfaten.- Maak een kruis naast deze woorden en een ander kruis in de buurt van S van SAG om te onthouden dat deze ionen de uitzonderingen zijn voor de oplosbaarheid van sulfaat.
Methode 3 De basisprincipes van leren
-

Controleer regelmatig. Informatie onthouden kost altijd tijd en werk. Hoe meer u uw lessen leest, hoe meer u zich op lange termijn zult herinneren. Herzie de regels vaak en test jezelf dagelijks op het onderwerp.- Vraag vrienden of familie om u vragen te stellen over dit onderwerp tijdens de lunch of het diner.
- Houd een exemplaar van de regels bij de hand voor beoordeling wanneer u wat vrije tijd heeft.
-

Maak samenvattingsbladen en gebruik ze. De kaarten zijn een uitstekend medium om een onderwerp snel te herzien en te onthouden. Let op de oplosbaarheidsregels op kaarten met enkele voorbeelden. Neem de bladen door totdat u bekend bent met de regels en namen van verbindingen die oplosbaar en onoplosbaar zijn.- Neem uw kaarten mee en neem ze mee om te bekijken in de auto of in afwachting van uw vrienden.
- Alle mogelijkheden zijn goed om uw vermeldingen te beoordelen.
-

Gebruik ezelsbruggetjes. De ezelsbruggetjes zijn tips om u te helpen informatie snel en gemakkelijk te onthouden. Wanneer je een ezelsbruggetje leert, kan het handig zijn om het meerdere keren te schrijven om het te onthouden. De ezelsbruggetjes zijn alleen handig als je weet wat elke letter betekent!- Oefen met het schrijven van de acroniemen en wat elke letter betekent.
- Wanneer u wordt beoordeeld, noteer dan eerst de ezelsbruggetjes voor toekomstig gebruik.